Олово(II) оксид
Олово(II) оксид, исто така наречено олово моноксид, ― неорганско соединение со молекуларна формула Pb O. PbO се јавува во два полиморфи: литаргит со четириагонална кристална структура и масикот со орторопмска кристална структура. Современите примени за PbO се претежно во индустриско стакло на база на олово и индустриска керамика, вклучително и сметачки компоненти. Тоа е амфотерен оксид.[1]
Подготовка
PbO може да се подготви со загревање на оловниот метал во воздух на приближно 600 °C. На оваа температура тој е и краен производ на оксидација на други оксиди на олово во воздухот:[2]
Топлинското разложување на олово(II) нитратот или олово(II) карбонатот, исто така, резултира со создавање на PbO:
- 2 Предлошка:Хем → 2 PbO + 4 Предлошка:Хем + Предлошка:Хем
- Предлошка:Хем → PbO + Предлошка:CO2
PbO се произведува во голем обем како среден производ при рафинирање на суровини оловни руди во метално олово. Вообичаената оловна руда е галена (олово(II) сулфид). На температура од околу 1,000 °C, сулфидот се претвора во оксид:[3]
- 2 PbS + 3 Предлошка:Хем → 2 PbO + 2 Предлошка:SO2
Структура
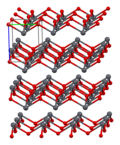
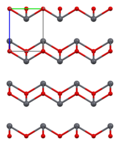
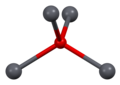
Како што е утврдено со рендгенска кристалографија, и полиморфните, четириагонални и орторомпски имаат пирамидно средиште со четири координати. Во четириагоналниот облик четирите олово-кислородни врски имаат иста должина, но во орторомпските две се пократки и две подолги. Пирамидната природа укажува на присуство на стереохемиски активен слободен електронски пар.[4] Кога PbO се јавува во четириагонална решеткаста структура тој е наречен литаргит; а кога PbO има орторомбна решеткаста структура се нарекува масикот. PbO може да се менува од масикот во литаргит или обратно со контролирано греење и ладење.[5] Четириагоналниот облик е обично црвена или портокалова боја, додека орторомпскиот обично е жолт или портокалов, но бојата не е многу сигурен показател за структурата.[6] Четириагоналните и орторомбните облици на PbO се јавуваат природно како ретки минерали.
| Единица ќелија | Пакување | Пакување | Пакување | Оловна координација | Кислородна координација |
|---|---|---|---|---|---|

|
|
|

|

|
|
| 3×3×3 единечни ќелии | гледано по оската a | гледано по оската c | квадратна пирамидна | искривен тетраедар |
Реакции
Метално олово се добива со намалување на PbO со јаглерод моноксид на околу 1,200 °C:[9]
- PbO + CO → Pb + CO
Црвените и жолтите облици на овој материјал се поврзани со мала промена во енталпијата:
- PbO (црвен) → PbO (жолт)Предлошка:ФатирањеΔ H = 1,6 kJ/mol
PbO е амфотерен, што значи дека реагира и со киселини и со бази. Со киселини, образува соли на Предлошка:Хем преку посредство на оксо кластери како што се Предлошка:Хем. Со силни основи, PbO се раствора за да образува плумбитни (исто така наречени плумбитни(II)) соли:[10]
- PbO + H2O + Предлошка:Хем → Предлошка:Хем
Примени
Видот на олово во оловното стакло обично е PbO, а PbO се користи интензивно во правењето стакло. Во зависност од стаклото, користа од употребата на PbO во стаклото може да биде една или повеќе од зголемување на показателот на прекршување на стаклото, намалување на вискозноста на стаклото, зголемување на електричната отпорност на стаклото и зголемување на способноста на стаклото да впива рендгенски зраци. Додавањето PbO на индустриската керамика (како и стаклото) ги прави материјалите магнетни и електрично поинертни (со зголемување на нивната Кириева температура) и често се користи за оваа намена.[11] Историски PbO исто така бил користен интензивно во керамичките глазури за керамика за домаќинство, и сè уште се користи, но не повеќе. Други помалку доминантни апликации вклучуваат вулканизација на гума и производство на одредени пигменти и бои. PbO се користи во стаклото од катодните цевки за блокирање на емисијата на рендгенските зраци, но главно во вратот и инката бидејќи може да предизвика промена на бојата кога се користи во предната плоча. За предната плоча се претпочитаат стронциум оксид и бариум оксид.[12]
Потрошувачката на олово, а со тоа и обработката на PbO, е во корелација со бројот на автомобили, бидејќи тоа останува клучната компонента на автомобилските оловно-киселински батерии.[13]
Помали или опаѓачки употреби
Мешавина од PbO со глицерин се зацврстува на тврд, водоотпорен цемент кој бил користен за спојување на рамните стаклени страни и дното на аквариумите, а некогаш се користел и за запечатување на стаклени панели во прозорските рамки. Тоа е составен дел на оловните бои.
PbO бил една од суровините за вековните јајца, еден вид кинески конзервирани јајца, но постепено бил заменуван поради здравствени проблеми. Тоа била бескрупулозна практика во некои мали фабрики, но станало неконтролирано во НР Кина и принудило многу чесни производители да ги означуваат своите кутии „без олово“ откако скандалот стана широко спространет во 2013 година.
Во облик на четириагонален литаргит во прав, може да се меша со ленено масло, а потоа да се вари за да се создаде големина отпорна на временски услови, што се користи при позлата. Литаргитот ќе и даде на големината темноцрвена боја што го направи златниот лист да изгледа топол и сјаен, додека лененото масло ќе даде адхезија и рамна издржлива површина за врзување.
PbO се користи во одредени реакции на кондензација во органската синтеза.[14]
PbO е влезниот фотопроводник во цевката за видеокамера наречена Plumbicon.
Здравствени проблеми
Оловниот оксид може да биде фатален ако се проголта или вдишува. Предизвикува иритација на кожата, очите и дишниот пат. Тоа влијае на ткивото на непцата, на централниот нервен систем, на бубрезите, на крвта и на репродуктивниот систем. Може да се биоакумулира кај растенијата и кај цицачите.[15]
Наводи
Надворешни врски
- Студии во медицината за животна средина - токсичност од олово Предлошка:Семарх
- Факти и прашања за токсичност: Олово Предлошка:Семарх
- Национален инвентар на загадувачи - Информации за олово и оловни соединенија
- Вебелементи PbO
Предлошка:Оксиди Предлошка:Нормативна контрола
- ↑ Предлошка:Ullmann
- ↑ Предлошка:Greenwood&Earnshaw2nd
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Wells5th
- ↑ A simple example is given in Предлошка:Наведена книга
- ↑ Предлошка:Наведена книга
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведена мрежна страница
- ↑ Lead Processing @ Universalium.academic.ru.
- ↑ Предлошка:Holleman&Wiberg
- ↑ Chapter 9, "Lead Compounds", in the book Ceramic and Glass Materials: Structure, Properties and Processing, published by Springer, year 2008.
- ↑ Предлошка:Наведена книга
- ↑ Предлошка:Ullmann
- ↑ Предлошка:OrgSynth
- ↑ Предлошка:Наведена мрежна страница