Бакар(I) хлорид


Бакар(I) хлорид, вообичаено наречен бакар хлорид — долниот хлорид на бакарот, со формулата CuCl. Супстанцијата е бела цврста цврстина ретко растворлива во вода, но многу растворлива во концентрирана хлороводородна киселина. Нечистите примероци изгледаат зелени поради присуството на бакар(II) хлорид (CuCl 2).[1]
Историја
Бакар(I) хлоридот првпат бил подготвен од Роберт Бојл во средината на XVII век [2] од жива (II) хлорид („Венецијански сублимат“) и бакар метал:
- HgCl 2 + 2 Cu → 2 CuCl + Hg
Во 1799 година, Ј.Л. Пруст ги карактеризирал двата различни хлориди на бакар. Тој го подготвил CuCl со загревање на CuCl 2 на црвена топлина во отсуство на воздух, предизвикувајќи го да изгуби половина од комбинираниот хлор проследено со отстранување на преостанатиот CuCl 2 со миење со вода.[3]
Киселиот раствор на CuCl порано се користел за анализа на содржината на јаглерод моноксид во гасовите, на пример во гасниот апарат на Хемпел .[4] Оваа апликација била значајна [5] во текот на 19 и почетокот на 20 век кога јагленот гас бил широко користен за греење и осветлување.
Синтеза
Бакар(I) хлорид се произведува индустриски со директна комбинација на бакар метал и хлор на 450-900 °C:[6][7]
Бакар(I) хлоридот може да се подготви и со редуцирање на бакар(II) хлорид со сулфур диоксид или со аскорбинска киселина (витамин Ц) што делува како редукционен шеќер:
Може да се користат и многу други редуцирачки агенси.[8]
-
Кристали од бел бакар(I) хлорид на бакарна жица
-
Бакар(I) хлорид делумно се оксидира во воздухот
Својства
Бакар(I) хлоридот има кубна кристална структура на цинкбленд при амбиентални услови. При загревање на 408 °C структурата се менува во шестаголна. Неколку други кристални форми на CuCl се појавуваат при високи притисоци (неколку GPa).
Бакар(I) хлорид е Луисова киселина, која е класифицирана како мека. Така, тој формира серија комплекси со меки Луисови киселини и бази како што е трифенилфосфинот:
- CuCl + 1 P(C 6 H 5 ) 3 → 1/4 {CuCl[P(C 6 H 5 ) 3 ]} 4
- CuCl + 2 P(C 6 H 5 ) 3 → CuCl[P(C 6 H 5 ) 3 )] 2
- CuCl + 3 P(C 6 H 5 ) 3 → CuCl[P(C 6 H 5 ) 3 )] 3
Иако CuCl е нерастворлив во вода, тој се раствора во водени раствори кои содржат соодветни донорски молекули. Формира комплекси со халидни јони, на пример, формирајќи H 3 O + CuCl 2 − во концентрирана хлороводородна киселина. Хлоридот е поместен со CN − и S <sub id="mwpw">2</sub> O <sub id="mwqA">3</sub> <sup id="mwqQ">2−</sup>.
Растворите на CuCl во HCl или NH3 апсорбираат јаглерод моноксид за да формираат безбојни комплекси како што е димерот премостен со хлорид [CuCl(CO)] 2. Истите раствори на хлороводородна киселина реагираат и со гасот ацетилен за да формираат [CuCl(C 2 H 2 )]. Амонијачните раствори на CuCl реагираат со ацетилени за да формираат експлозивни бакар(I) ацетилид, Cu 2 C2. Алкеновите комплекси o може да се подготват со редукција на CuCl <sub id="mwuQ">2</sub> со сулфур диоксид во присуство на алкен во раствор на алкохол. Комплексите со диени како 1,5-циклооктадиен се особено стабилни:[9]
Во отсуство на други лиганди, неговите водени раствори се нестабилни во однос на диспропорционалноста:
- 2 CuCl → Cu + CuCl 2
Делумно поради оваа причина примероците во воздухот добиваат зелена боја.
Употреба
Главната употреба на бакар(I) хлорид е како претходник на фунгицидот бакар оксихлорид. За таа цел, воден бакар(I) хлорид се генерира со компропорција и потоа се оксидира со воздух:
- Cu + CuCl 2 → 2 CuCl
- 4 CuCl + O 2 + 2 H2O → Cu 3 Cl 2 (OH) 4 + CuCl 2
Бакар(I) хлоридот катализира различни органски реакции, како што е дискутирано погоре. Неговиот афинитет за јаглерод моноксид во присуство на алуминиум хлорид е искористен во процесот COPure SM .
Во органската синтеза
CuCl се користи со јаглерод моноксид, алуминиум хлорид и хлороводород во реакцијата Гатерман-Кох за да се формираат бензалдехиди.
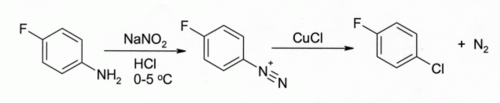
Во реакцијата на Сендмаер.[10][11] Третманот на арениазониумова сол со CuCl доведува до арил хлорид, на пример:
Реакцијата има широк опсег и обично дава добри приноси.
Раните истражувачи забележале дека бакар(I) халидите катализираат 1,4-додавање на Грињардовите реагенси во алфа, бета-незаситени кетони [12] довеле до развој на органски реагенси кои се широко користени денес во органската синтеза:[13]
Ова откритие довело до развој на органобакарната хемија. На пример, CuCl реагира со метилитиум (CH 3 Li) за да формира „Гилманови реагенси“ како што е (CH 3) 2 CuLi, кои наоѓаат широка употреба во органската синтеза. Грињардовите реагенси формираат слични органобакарни соединенија. Иако другите бакар(I) соединенија како бакар(I) јодид сега почесто се користат за овие типови реакции, бакар(I) хлоридот сè уште се препорачува во некои случаи:[14]
Овде, Bu означува n- бутил група. Без CuCl, Грињардовиот реагенс сам дава мешавина од 1,2- и 1,4-додатоци на производи (т.е., бутилот се додава на C поблиску до C=O).
Бакар(I) хлоридот е исто така посредник формиран од бакар(II) хлорид во процесот на Вакер.
Во полимерната хемија
CuCl се користи како катализатор во полимеризација на радикални преноси на атом (ATRP).
Бакар(I) хлоридот се користи и во пиротехниката како сино/зелено средство за боење. При тест на пламен, бакарните хлориди, како и сите бакарни соединенија, емитуваат зелено-сина боја.
Природна појава
Природна форма на CuCl е реткиот минерал нантокит.[15][16]
Наводи
Надворешни врски
- Национален инвентар на загадувачи – информативен лист за бакар и соединенија
- Процесот COPure SM за прочистување на CO со користење на комплекс од бакар хлорид
Предлошка:Соединенија на бакаротПредлошка:Хлориди
- ↑ Pastor, Antonio C. (1986) Предлошка:US Patent "Method of preparing cupric ion free cuprous chloride" Section 2, lines 4–41.
- ↑ Предлошка:Наведена книга
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведена книга
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведена книга
- ↑ Предлошка:Наведена книга
- ↑ Предлошка:Наведена книга
- ↑ Nicholls, D. (1973) Complexes and First-Row Transition Elements, Macmillan Press, London.
- ↑ Wade, L. G. (2003) Organic Chemistry, 5th ed., Prentice Hall, Upper Saddle River, New Jersey, p. 871. Предлошка:ISBN
- ↑ March, J. (1992) Advanced Organic Chemistry, 4th ed., Wiley, New York. p. 723. Предлошка:ISBN
- ↑ Предлошка:Наведено списание
- ↑ Jasrzebski, J. T. B. H.; van Koten, G. (2002) Modern Organocopper Chemistry, N. Krause (ed.
- ↑ Bertz, S. H.; Fairchild, E. H. (1999) Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation, R. M. Coates, S. E. Denmark (eds.
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница