Закиселување на океаните
[[Податотека:Estimated change in annual mean sea surface pH from 1770s-1990s (GLODAP).png|алт=World map showing the varying change to pH across different parts of different oceans|мини| Проценета промена во pH на морската вода предизвикана од [[Јаглерод диоксид|Предлошка:Хем]] создаден од човекот помеѓу 1700-тите и 1990-тите, од Проектот за глобална анализа на податоци на океанот (GLODAP) и Светскиот океански атлас]]



Закиселување на океаните — тековно намалување на pH вредноста на океаните на Земјата, предизвикано од навлегувањето на јаглерод диоксид (Предлошка:CO2) од атмосферата.[2] Главната причина за закиселување на океаните се човечките активности, имено согорувањето на фосилните горива. Како што се зголемува количината на јаглерод диоксид во атмосферата, се зголемува и количината на јаглерод диоксид што се апсорбира од океанот. Ова доведува до серија хемиски реакции во морската вода и има негативно прелевање на океанот и живите видови кои живеат под вода.[3] Кога јаглерод диоксидот се раствора во морската вода, образува јаглеродна киселина (H2CO3).
Закиселувањето на океаните влијае на многу видови, особено на организмите како остриги и корали. Тоа е еден од неколкуте ефекти на климатските промени врз океаните. Морската вода е малку основна (што значи pH > 7), а закиселувањето на океаните вклучува поместување кон pH-неутрални услови наместо преод кон кисели услови (pH < 7).[4] Загриженоста со закиселувањето на океаните е тоа што може да доведе до намалено производство на школки и други водни животни со школки од калциум карбонат, како и некои други физиолошки предизвици за морските организми. Организмите обложени со калциум карбонат не можат да се репродуцираат под високо заситени ацидотични води. Дел од него реагира со водата и образува јаглеродна киселина. Некои од добиените молекули на јаглеродна киселина се дисоцираат во бикарбонатен јон и водороден јон, со што се зголемува киселоста на океаните (концентрација на H+ јони).
Помеѓу 1751 и 1996 година, се проценува дека pH вредноста на површината на океанот се намалила од приближно 8,25 на 8,14,[5] што претставува зголемување од речиси 30% во концентрацијата на јони H+ во светските океани (забележливо е дека рН скалата е логаритамска, така што промена од една во pH единица е еквивалентна на десеткратна промена во концентрацијата на H+ јони).[6][7] Според Националната океанска и атмосферска управа, pH вредноста на океаните денес е 8,1.[3] Постои варијација во pH вредноста на морската површина на глобално ниво со постудени и повисоки океани кои имаат способност да растворат повеќе CO2 и затоа дополнително да ја зголемат нивната киселост, како и пониски нивоа на заситеност со бикарбонати, за возврат намалувајќи ја способноста на морските организми да произведуваат тврди школки.[8] Фактори како што се океанските струи, големите континентални реки кои ја разредуваат соленоста на морската вода, топењето на мразот и таложењето на азот и сулфур од согорувањето на фосилните горива и земјоделството, исто така влијаат на киселоста на океаните.[9]
Се смета дека зголемената киселост има низа потенцијално штетни последици за морските организми како што се депресивни метаболички стапки и имунолошки реакции кај некои организми и предизвикување белење на коралите.[10] Закиселувањето на океаните влијае на екосистемите на морските средини кои обезбедуваат храна, средства за живот и други екосистемски услуги за голем дел од човечката популација. Околу 1 милијарда луѓе се целосно или делумно зависни од екосистемските услуги што ги обезбедуваат коралните гребени во однос на риболов, туризам и управување со крајбрежјето.[11] Со зголемување на присуството на слободни водородни јони, дополнителната јаглеродна киселина што се образува во океаните на крајот резултира со претворање на карбонатните јони во бикарбонатни јони. Алкалноста на океаните не се менува со процесот или може да се зголеми во долги временски периоди поради растворање на карбонат.[12] Ова нето намалување на бројот на достапни карбонатни јони може да им отежне на морските калцифицирачки организми, како што се коралите и некои планктони, да образуваат биоген калциум карбонат, а таквите структури стануваат ранливи на растворање.[13] Поради тоа, тековното закиселување на океаните може да ги загрози идните синџири на исхрана поврзани со океаните.[14][15]
Главното решение за закиселување на океаните лежи во намалувањето на нивото на CO2 во атмосферата. Како членови на Интеракадемскиот панел, 105 научни академии дале изјава за закиселување на океаните во која препорачуваат до 2050 година, глобалните емисии на CO2 да се намалат за најмалку 50% во споредба со нивото од 1990 година.[16] Целта 14 за одржлив развој на Обединетите нации („Живот под вода“) има цел да ги „минимизира и да ги реши влијанијата од закиселувањето на океаните“.[17]
Закиселувањето на океаните се случило претходно во историјата на Земјата,[18] и резултирачкиот еколошки колапс во океаните имал долготрајни ефекти врз глобалниот јаглероден циклус и климата.[19][20]
Причини и јаглероден циклус

Човечките активности како што се согорувањето на фосилните горива и промените во користењето на земјиштето довеле до нов проток на Предлошка:Хем во атмосферата. Околу 45% останало во атмосферата; поголемиот дел од остатокот е преземен од океаните,[21] со дел од копнените растенија.[22]

Јаглеродниот циклус ги опишува флуксот на јаглерод диоксид (Предлошка:Хем) помеѓу океаните, копнената биосфера, литосферата, и атмосферата. Јаглеродниот циклус вклучува и органски соединенија како целулоза и неоргански јаглеродни соединенија како што се јаглерод диоксид, карбонат јон и бикарбонат јон. Неорганските соединенија се особено релевантни кога се зборува за закиселување на океаните бидејќи тие вклучуваат многу форми на растворен Предлошка:Хем присутни во океаните на Земјата.[25]
Кога Предлошка:Хем се раствора, реагира со вода за да образува рамнотежа на јонски и нејонски хемиски видови: растворен слободен јаглерод диоксид (Предлошка:Хем), јаглеродна киселина (Предлошка:Хем), бикарбонат (Предлошка:Хем) и карбонат (Предлошка:Хем). Односот на овие видови зависи од фактори како што се температурата на морската вода, притисокот и соленоста. Овие различни форми на растворен неоргански јаглерод се пренесуваат од површината на океанот до неговата внатрешност со помош на океанската пумпа за растворливост.
Отпорот на површина од океанот на апсорпција на атмосферски Предлошка:Хем е познат како Ревелов фактор.
Закиселувањето на океаните е споредено со антропогените климатски промени и се нарекува „злобниот близнак на глобалното затоплување“ [26][27][28][29][30] и „другиот проблем со CO2“.[27][29][31] Зголемените температури на океаните и загубата на кислород дејствуваат истовремено со закиселувањето на океаните и го сочинуваат „смртоносното трио“ на притисоци од климатските промени врз морската средина.[32] Се смета дека и слатководните тела се закиселуваат, иако ова е покомплексен и помалку очигледен феномен.[33][34]
Се проценува дека 30-40% од јаглерод диоксидот од човековата активност ослободен во атмосферата се раствора во океани, реки и езера.[23][35]
Механизам на закиселување
Распуштање на Предлошка:Хем во морската вода го зголемува водородниот јон (Предлошка:Хем) концентрација во океанот, а со тоа и ја намалува pH вредноста на океанот, како што следува:[36]
Приближно една третина од јаглерод диоксидот ослободен во атмосферата со човечка активност се раствора во океаните, реките и езерата, што резултира со зголемени нивоа на закиселување.[37] Нивото на киселоста на површината на океаните се зголемила за 30% од почетокот на индустриската револуција.
Од почетокот на индустриската револуција, океанот апсорбира околу една третина од Предлошка:Хем [38] и се проценува дека pH вредноста на површината на океанот се намалила за нешто повеќе од 0,1 единица на логаритамската скала на pH, што претставува околу 29% зголемување на Предлошка:Хем. Се очекува да се намали за дополнителни 0,3 до 0,5 pH единици [39] (дополнително удвојување до тројно зголемување на денешните концентрации на постиндустриска киселина) до 2100 година бидејќи океаните апсорбираат повеќе антропоген Предлошка:Хем, влијанијата се најтешки за коралните гребени и Јужниот Океан.[2] Се предвидува дека овие промени ќе се забрзаат како поантропоген Предлошка:Хем се ослободува во атмосферата и се зема од океаните. Степенот на промена на океанската хемија, вклучително и pH на океаните, ќе зависи од патеките за ублажување и емисиите [40] преземени од општеството.[41]
Иако најголемите промени се очекуваат во иднина, извештај од научниците на NOAA покажале дека големи количини на вода незаситена во арагонит веќе се зголемуваат во близина на областа на континенталниот праг на Тихиот Океан во Северна Америка.[1] Континенталните полици играат важна улога во морските екосистеми, бидејќи повеќето морски организми живеат таму, и иако студијата се занимавала само со областа од Ванкувер до Северна Калифорнија, авторите сугерираат дека другите области на гребенот може да искусат слични ефекти.[1]
| Време | pH вредност | Релативна промена на pH до прединдустриски |
Извор | H + промена на концентрацијата во однос на прединдустрискиот |
|---|---|---|---|---|
| Прединдустриски (18 век) | 8.179 | анализирано поле [42] [ неуспешна верификација ] | ||
| Неодамнешно минато (1990-ти) | 8.104 | −0,075 | поле [42] | + 18,9% |
| Сегашни нивоа | ~ 8.069 | −0,11 | поле [7][43][44] | + 28,8% |
| 2050 (2× Предлошка:Хем = 560 ppm) | 7.949 | −0,230 | модел [13] [ неуспешна верификација ] | + 69,8% |
| 2100 (IS92a) | 7.824 | −0,355 | модел [13] [ неуспешна верификација ] | + 126,5% |

Во плитки крајбрежни региони, голем број фактори се вкрстуваат за да влијаат на промената на pH вредноста покрај атмосферскиот Предлошка:Хем.[45][46] Тие вклучуваат биолошки процеси, како што се фотосинтезата и дишењето,[47] и издигнувањето на водата на брегот може да се измени со овие процеси.[48][49][50] Исто така, метаболизмот на екосистемот во слатководните извори што стигнуваат до крајбрежните води може да доведе до големи промени на pH таму,[45] со стапки на биолошки индуцирана промена на pH зависни од локалната температура на водата.
Набљудувани стапки
Предлошка:Reduced pull quote Една од првите детални збирки на податоци за испитување како рН варирала во текот на 8 години на одредена северна умерена крајбрежна локација открила дека закиселувањето има силни врски со динамиката на in situ видови и дека варијацијата во pH вредноста на океаните може да предизвика варовничките видови да имаат полошо од неваровничките видови во години со ниска pH вредност и предвидува последици за бенталните екосистеми во близина на брегот.[51][52]
Сегашните стапки на закиселување на океаните се споредени со настанот на стаклена градина на границата Палеоцен-Еоцен (околу 55 пред милиони години) кога температурата на површината на океаните се зголемила за 5-6 степени целзиусови. Не била забележана катастрофа во површинските екосистеми, но сепак организмите кои живеат на дното во длабоките океани доживеале големо истребување. Тековната киселост е на пат да достигне нивоа повисоки од било кое забележано во последните 65 милиони години,[53][54][55] и стапката на пораст е околу десет пати поголема од стапката што му претходела на палеоценско-еоценското масовно изумирање. Сегашната и проектираната киселост е опишана како речиси невиден геолошки настан.[56] Студијата на Националниот совет за истражување објавена во април 2010 година исто така заклучила дека „нивото на киселина во океаните се зголемува со невидена брзина“.[57][58] Еден труд од 2012 година во списанието Science го испитувала геолошкиот запис во обид да најде историски аналог за сегашните глобални услови, како и за оние во иднината. Истражувачите утврдиле дека моменталната стапка на закиселување на океаните е побрза отколку кога било во изминатите 300 милиони години.[59][60]
Преглед на климатските научници на блогот RealClimate, на извештајот од 2005 година на Кралското друштво на Обединетото Кралство на сличен начин ја истакнала централноста на стапките на промена во сегашниот процес на антропогена киселост, пишувајќи:[61]
„Природната pH вредност на океанот е одредена од потребата да се балансира таложењето и закопувањето на Предлошка:Хем на морското дно против приливот на Предлошка:Хем и Предлошка:Хем во океанот од растворање на карпите на копно, наречено атмосферски влијанија. Овие процеси ја стабилизираат pH вредноста на океанот, со механизам наречен Предлошка:Хем компензација... Поентата да се изнесе повторно е да се забележи дека ако Предлошка:Хем концентрацијата на атмосферата се менува побавно од ова, pH вредноста на океанот ќе биде релативно непроменета бидејќи Предлошка:Хем може да продолжи. [сегашната] киселост на фосилните горива е многу побрза од природните промени, и затоа скокот на киселината ќе биде поинтензивен отколку што Земјата видела во најмалку 800.000 години."
Само во 15-годишниот период 1995-2010 година, киселоста се зголемила за 6 проценти во горните 100 метри на Тихиот Океан од Хаваи до Алјаска.[62] Според изјавата во јули 2012 година на Џејн Лубченко, шеф на американската Национална океанска и атмосферска администрација „површинските води се менуваат многу побрзо отколку што сугерираа првичните пресметки. Тоа е уште една причина да бидеме многу сериозно загрижени за количината на јаглерод диоксид што сега е во атмосферата и дополнителната количина што продолжуваме да ја исфрламе.“ [26]
Една студија од 2013 година тврди дека киселоста се зголемува со брзина 10 пати побрзо отколку во која било од еволутивните кризи во историјата на Земјата.[63] Во синтетичкиот извештај објавен во Science во 2015 година, 22 водечки поморски научници изјавиле дека од согорувањето на фосилните горива ја менува хемијата на океаните побрзо од кога било од Големото истребување, најтешкиот познат настан на истребување на Земјата, нагласувајќи дека 2 °C максималното зголемување на температурата договорено од владите го одразува премалото намалување на емисиите за да се спречат „драматичните влијанија“ врз светските океани, при што водечкиот автор Жан-Пјер Гатузо забележал дека „Океанот беше минимално земен предвид на претходните преговори за климата. Нашата студија дава убедливи аргументи за радикална промена на конференцијата на ОН (во Париз) за климатските промени.“ [64]
Брзината со која ќе се појави закиселување на океаните може да биде под влијание на стапката на затоплување на површинските океани, бидејќи хемиските рамнотежи кои управуваат со pH на морската вода зависат од температурата.[65] Поголемото затоплување на морската вода може да доведе до помала промена на pH вредноста за дадено зголемување на CO2.[65] Разликата во промените во температурата и соленоста помеѓу басените е една од главните причини за разликите во стапките на закиселување во различни локалитети.
| Место | Стапка на закиселување (10 −3 pH единици / година) | Период | Извор на податоци |
|---|---|---|---|
| Исланд [66] | -2.4 | 1984 – 2009 година | Директни мерења |
| Пасаж Дрејк [67] | -1,8 | 2002 – 2012 година | Директни мерења |
| Канари[68] | -1,7 | 1995 – 2004 година | Директни мерења |
| Хаваи[69] | -1,9 | 1989 – 2007 година | Директни мерења |
| Бермуди[70] | -1,7 | 1984 – 2012 година | Директни мерења |
| Коралното море [71] | -0,2 | ~ 1700 - ~ 1990 година | Реконструкција на прокси |
| Источен Медитеран [72] | -2.3 | 1964 – 2005 година | Реконструкција на прокси |
Предвидени идни стапки
Проектот Наука за Земјиниот систем информира дека, до околу 2008 година, киселоста на океаните ги надминала историските аналози [73] и, во комбинација со други биогеохемиски промени на океаните, може да го поткопа функционирањето на морските екосистеми и да го наруши обезбедувањето на многу добра и услуги поврзани со почетокот на океанот како уште во 2100 г.[39]
Доколку опстојува моделот „бизнис како и обично“ за човековата активност, се проценува дека pH вредноста на океаните во 2100 година би можела да се намали за 0,2 до 0,5 единици во споредба со денешниот ден.[74] Океаните не го доживеале ова ниво на киселост 14 милиони години.[75]
Се предвидува дека ќе се случи еколошка пресвртна точка до 2030 година, а најдоцна до 2038 година [76] Томас Лавџој, поранешен главен советник за биолошка разновидност на Светската банка, посочил дека киселоста на океаните ќе се удвои во следните 40 години. Тој изјавил дека оваа стапка е 100 пати поголема од какви било промени во киселоста на океаните во последните 20 милиони години, што го прави малку веројатно дека морскиот живот некако може да се прилагоди на промените.[77] Се предвидува дека до 2100 година, доколку истовремените биогеохемиски промени влијаат на испораката на океанските добра и услуги, тогаш тие исто така би можеле да имаат значителен ефект врз човековата благосостојба на оние кои многу се потпираат на океанот за храна, работа и приходи.
Експерти кои претходно учествувале во извештаите на IPCC утврдиле дека сè уште не е можно да се одреди праг за киселост на океаните што не треба да се надмине.[78]
Ефекти врз калцификацијата
Промените во хемијата на океаните може да имаат екстензивни директни и индиректни ефекти врз организмите и нивните живеалишта. Една од најважните последици од зголемената киселост на океаните се однесува на производството на школки и плочи од калциум карбонат (Предлошка:Хем).[79] Овој процес се нарекува калцификација и е важен за биологијата и опстанокот на широк опсег на морски организми. Калцификацијата вклучува таложење на растворени јони во цврст Предлошка:Хем структури, како што се коколити. Откако ќе се образуваат, таквите структури се ранливи на растворање, освен ако околната морска вода содржи заситени концентрации на карбонатни јони (CO 3 2-).
Механизам

Од дополнителниот јаглерод диоксид додаден во океаните, дел останува како растворен јаглерод диоксид, додека остатокот придонесува за создавање дополнителен бикарбонат (и дополнителна јаглеродна киселина). Ова исто така ја зголемува концентрацијата на водородните јони, а процентот на зголемување на водородот е поголем од процентуалното зголемување на бикарбонатот,[80] создавајќи нерамнотежа во реакцијата HCO 3 − ⇌ CO 3 2− + H +. За да се одржи хемиската рамнотежа, некои од карбонатните јони кои се веќе во океанот се комбинираат со некои од водородните јони за да направат понатамошен бикарбонат. Така, концентрацијата на карбонатните јони во океанот е намалена, создавајќи нерамнотежа во реакцијата Ca 2+ + CO 3 2− ⇌ CaCO 3 и со што се прави растворање на образуваните Предлошка:Хем структури поверојатно.
Зголемувањето на концентрациите на растворениот јаглерод диоксид и бикарбонат, и намалувањето на карбонатот, се прикажани на Бјерум.
Состојба на растворливост
Состојбата на растворливост (позната како Ω) на морската вода за минерал е мерка за термодинамичкиот потенцијал за образување или растворање на минералот, а за калциум карбонат е опишан со следнава равенка:
Овде Ω е производ на концентрациите (или активностите) на јоните кои реагираат што го образуваат минералот (Ca2+ и CO2− 3), поделено со производот од концентрациите на тие јони кога минералот е во рамнотежа (К sp), односно кога минералот ниту се образува ниту се раствора. Во морската вода, природната хоризонтална граница се образува како резултат на температурата, притисокот и длабочината и е позната како хоризонт на заситеност[79]. Над овој хоризонт на растворливост, Ω има вредност поголема од 1, а CaCO3 не се раствора лесно. Повеќето калцифицирачки организми живеат во такви води. Под оваа длабочина, Ω има вредност помала од 1, а CaCO3 ќе се раствори. Меѓутоа, ако неговата стапка на производство е доволно висока за да се надомести растворањето, CaCO3 сè уште може да се појави каде што Ω е помало од 1. Длабочината на компензација на карбонат се јавува на длабочината во океанот каде што производството е надминато со растворање[81].
Намалувањето на концентрацијата на CO3 2− го намалува Ω, и оттука го прави Предлошка:Хем поверојатно е распаѓање.
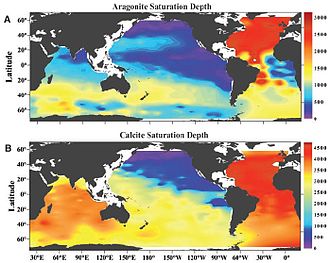
Калциум карбонатот се јавува во два вообичаени полиморфи (кристални форми): арагонит и калцит. Арагонитот е многу порастворлив од калцитот, така што хоризонтот на растворливост на арагонит е секогаш поблиску до површината од хоризонтот на заситеност со калцит.[79] Ова исто така значи дека оние организми кои произведуваат арагонит може да бидат поранливи на промени во киселоста на океаните отколку оние што произведуваат калцит.[13] Зголемување на Предлошка:Хем нивоа и резултирачката пониска pH вредност на морската вода ја намалува состојбата на заситеност на Предлошка:Хем и ги подига хоризонтите на заситеност на двете форми поблиску до површината.[82] Се верува дека ова намалување на состојбата на растворливост е еден од главните фактори што доведува до намалена калцификација кај морските организми, бидејќи неорганските врнежи на Предлошка:Хем е правопропорционална на неговата состојба на растворливост.[83]
Влијанија
Податотека:Impacts of ocean acidification (NOAA EVL).webm Зголемувањето на киселоста има веројатно штетни последици, како што се депресивни стапки на метаболизмот кај џамбо лигњите,[84] депресирање на имунолошките одговори на сините школки,[85] и белење на коралите.
Извештаите „Резиме за закиселување на океаните за креаторите на политиките 2013“ и IPCC одобриле „Специјален извештај за океанот и криосферата во климата што се менува“ од 2019 година ги опишуваат наодите од истражувањето и можните влијанија.[86][87]
Корално белење
Феноменот на корално белење или избелување на коралите и дегенерација на екосистемите на коралните гребени е една од последиците на зголемената киселост на океаните. Тропските и суптропските средини, вклучувајќи области како што се Карибите и околните региони, тропска Азија (на пр. Индонезија, Филипини, Тајланд, Малдиви) и тропскиот Тихи Океан (на пр Австралискиот корален гребен, тихоокеанските острови, Папуа Нова Гвинеја) се најмногу погодени од корално белење, бидејќи тоа се регионите во светот кои ги содржат најголемите и најобемните системи на корални гребени.[88]
Влијанија врз океанските организми

Зголеменото закиселување на океаните го отежнува пристапот на организмите што создаваат школки до карбонатните јони, неопходни за производство на нивната тврда егзоскелетна обвивка. Океанските калцифицирачки организми го опфаќаат синџирот на исхрана од автотрофи до хетеротрофи и вклучуваат организми како што се коколитофори, корали, фораминифери, ехинодерми, ракови и мекотели. Како што е опишано погоре, во нормални услови, калцитот и арагонитот се стабилни во површинските води бидејќи карбонатниот јон е во презаситени концентрации. Меѓутоа, како што опаѓа pH на океаните, концентрацијата на карбонатните јони исто така се намалува, а кога карбонатот станува недозаситен, структурите направени од калциум карбонат се ранливи на растворање. Затоа, дури и ако нема промена во стапката на калцификација, стапката на растворање на варовничкиот материјал се зголемува.[89]

Корали,[90][91][92][93] коколитофорни алги,[94][95][96][97] коралини алги,[98] фораминифери,[99] школки [100] и птероподи[13][101] имаат зголемено растворање кога се изложени на покачен Предлошка:Хем.
Кралското друштво објавило сеопфатен преглед на закиселувањето на океаните и неговите потенцијални последици, во јуни 2005 година.[79] Сепак, некои студии пронашле различни одговори на закиселувањето на океаните, при што калцификацијата и фотосинтезата на коколитофор се зголемуваат при покачена атмосферска pCO2,[102][103][104] еднаков пад на примарното производство и калцификацијата како одговор на покаченото CO2 [105] или насоката на одговорот варира помеѓу видовите.[106] Студијата во 2008 година, која го испитувала јадрото на седиментот од Северен Атлантик, покажала дека иако составот на видовите на коколитофоридите останал непроменет за индустрискиот период од 1780 до 2004 година, калцификацијата на коколитите се зголемила до 40% во исто време.[104] Студијата од 2010 година од Универзитетот Стони Брук сугерирала дека додека некои области се прекумерно ожнеани и други риболовни терени се обновуваат, поради закиселувањето на океаните можеби е невозможно да се вратат многу претходни популации на школки. Иако целосните еколошки последици од овие промени во калцификацијата се сè уште неизвесни, се чини дека многу видови кои калцифицираат ќе бидат негативно погодени.
Кога биле изложени во експерименти на pH намалена за 0,2 до 0,4, ларвите на умерена кршлива ѕвезда, роднина на обичната морска ѕвезда, помалку од 0,1 отсто преживеале повеќе од осум дена. Исто така, постои сугестија дека падот на коколитофорите може да има секундарни ефекти врз климата, придонесувајќи за глобалното затоплување со намалување на албедото на Земјата преку нивните ефекти врз облачноста на океаните.[107] Сите морски екосистеми на Земјата ќе бидат изложени на промени во закиселувањето и на неколку други биогеохемиски промени во океаните.
Течноста во внатрешните одделенија (целентерон) каде коралите го растат нивниот егзоскелет е исто така исклучително важна за растот на калцификацијата. Кога стапката на заситеност на арагонитот во надворешната морска вода е на амбиентално ниво, коралите брзо ќе ги растат своите арагонитни кристали во нивните внатрешни прегради, па оттука нивниот егзоскелет брзо расте. Ако нивото на арагонит во надворешната морска вода е пониско од нивото на околината, коралите мора да работат понапорно за да ја одржат вистинската рамнотежа во внатрешниот оддел. Кога тоа ќе се случи, процесот на растење на кристалите се забавува, а тоа ја забавува брзината на тоа колку расте нивниот егзоскелет. Во зависност од тоа колку арагонит има во околната вода, коралите може дури и да престанат да растат бидејќи нивоата на арагонит се премногу ниски за да се втурнат во внатрешниот оддел. Тие дури може да се растворат побрзо отколку што можат да направат кристали во нивниот скелет, во зависност од нивото на арагонит во околната вода.[108] Според сегашната прогресија на емисиите на јаглерод, околу 70% од северноатлантските ладни корали ќе живеат во корозивни води до 2050-60 година.[109]
Студијата спроведена од океанографската институција Вудс Хол во јануари 2018 година покажала дека скелетниот раст на коралите во закиселени услови е примарно под влијание на намалениот капацитет за градење густи егзоскелети, наместо да влијае на линеарното проширување на егзоскелетот. Користејќи глобални климатски модели, тие покажуваат дека густината на некои видови корали може да се намали за над 20% до крајот на овој век.[110]
Експериментот на самото место на површина од 400 m 2 на Големиот корален гребен за намалување на нивото на CO2 на морската вода (покачување на pH) до приближно до прединдустриската вредност покажала зголемување од 7% во нето калцификацијата.[111] Сличен експеримент за подигање на нивото на CO2 на морската вода на ниво што се очекува наскоро по средината на овој век покажала дека нето калцификацијата се намалила за 34%.[112]
Закиселувањето на океаните може да принуди некои организми да ги прераспределат ресурсите подалеку од продуктивни крајни точки како што е растот со цел да се одржи калцификацијата.[113] На пример, остригите, Magallana gigas, се препознаваат дека доживуваат метаболички промени заедно со изменетите стапки на калцификација поради енергетските размени кои произлегуваат од нерамнотежа на pH.[114]
На некои места јаглерод диоксидот излегува од морското дно, локално менувајќи ја pH вредноста и другите аспекти на хемијата на морската вода. Студиите за овие протекувања на јаглерод диоксид документирале различни одговори од различни организми. Заедниците на коралните гребени сместени во близина на вливот на јаглерод диоксид се од особен интерес поради чувствителноста на некои видови корали на закиселување. Во Папуа Нова Гвинеја, намалувањето на pH вредноста предизвикано од навлегувањето на јаглерод диоксид е поврзано со падот на разновидноста на видовите на коралите.[115] Сепак, во Палау протекувањето на јаглерод диоксид не е поврзано со намалената разновидност на видовите на коралите, иако биоерозијата на коралните скелети е многу повисока на места со ниска pH вредност.
Закиселувањето на океаните може да влијае на океанските биолошки водени секвестрации на јаглерод од атмосферата во внатрешноста на океаните и седиментот на морското дно, слабеејќи ја таканаречената биолошка пумпа.[116] Закиселувањето на морската вода, исто така, може да ги направи фитопланктоните на Антарктикот помали и помалку ефикасни во складирањето на јаглеродот.[117] Ваквите промени се повеќе се проучуваат и синтетизираат преку употреба на физиолошки рамки.
Други биолошки влијанија
Освен забавувањето и/или враќањето на калцификацијата, организмите може да претрпат други негативни ефекти, или индиректно преку негативни влијанија врз ресурсите на храна,[79] или директно како репродуктивни или физиолошки ефекти. На пример, покачените океански нивоа на CO може да произведат Предлошка:Хем индуцирана закиселување на телесните течности, позната како хиперкапнија. Исто така, се верува дека зголемувањето на киселоста на океаните има низа директни последици. На пример, зголемената киселост е забележана за: намалување на метаболичките стапки во џамбо лигњите;[84] ги намалува имунолошките одговори на сините школки.[85] Ова е веројатно затоа што закиселувањето на океаните може да ги промени акустичните својства на морската вода, дозволувајќи му на звукот дополнително да се шири и да ја зголеми бучавата од океанот.[118] Ова влијае на сите животни кои користат звук за ехолокација или комуникација.[119] На јајцата на лигњите од Атлантикот им било потребно подолго време да се изведат во закиселена вода, а статолитот на лигњите бил помал и погрешно образуван кај животните сместени во морска вода со пониска pH вредност. Пониската PH била симулирана со 20-30 пати повеќе од нормалната количина на Предлошка:Хем.[120] Сепак, како и кај калцификацијата, сè уште нема целосно разбирање на овие процеси во морските организми или екосистеми.[121]
Друг можен ефект би бил зголемувањето на појавата на црвените плими, што може да придонесе за акумулација на токсини кај малите организми како што се сарделата и школките, за возврат зголемување на појавата на труење со амнестични школки, невротоксично труење со школки и паралитично труење со школки.[122]
Иако црвената плима е штетна, други корисни фотосинтетички организми можат да имаат корист од зголеменото ниво на јаглерод диоксид. Што е најважно, морските треви ќе имаат корист.[123] Експериментот направен во 2018 година заклучил дека како што морските треви ја зголемуваат својата фотосинтетичка активност, стапките на калцификација на алгите се зголемуваат. Ова може да биде потенцијална техника за ублажување во услови на зголемена киселост.[123]
Закиселувањето на океаните може да биде од корист за некои видови, на пример зголемување на стапката на раст на морската ѕвезда, Pisaster ochraceus. [124]
Рибини лаври
Закиселувањето на океаните исто така може да има влијание врз ларвите на морските риби. Тоа внатрешно влијае на нивните миризливи системи, што е клучен дел од нивниот развој, особено во почетната фаза од нивниот живот. Портокаловите ларви претежно живеат на океанските гребени кои се опкружени со вегетативни острови.[125] Со користење на нивното сетило за мирис, познато е дека ларвите можат да ги откријат разликите помеѓу гребените опкружени со вегетативни острови и гребените кои не се опкружени со вегетативни острови.[125] Ларвите на рибите-кловн треба да бидат способни да прават разлика помеѓу овие две дестинации за да имаат способност да лоцираат област која е задоволителна за нивниот раст. Друга употреба на системите за миризба на морските риби е да се помогне во одредувањето на разликата помеѓу нивните родители и другите возрасни риби со цел да се избегне оплодување помеѓу крвни сродници.
Во експерименталниот објект за аквариум на Универзитетот Џејмс Кук, рибите-кловн се одржувале во неманипулирана морска вода која добила pH од 8,15 ± 0,07, што е слична на pH вредноста на нашиот сегашен океан. За да се тестираат ефектите на различни нивоа на pH, морската вода била манипулирана на три различни pH нивоа, вклучувајќи ја и неманипулираната pH вредност. Двете спротивставени нивоа на pH кореспондираат со моделите за климатски промени кои ги предвидуваат идните атмосферски нивоа на CO2.[125] Во 2100 година, моделот предвидува дека потенцијално би можеле да се добие ново на 1.000 ppm, што е во корелација со pH од 7,8 ± 0,05. Резултатите од овој експеримент покажуваат дека кога ларвите се изложени на pH од 7,8 ± 0,05, нивната реакција на знаците на животната средина драстично се разликува од реакцијата на ларвите на знаците во неманипулирана pH вредност. На pH од 7,6 ± 0,05 ларвите немале реакција на било кој тип на знак. Овие резултати ги прикажуваат негативните исходи што веројатно би можеле да бидат иднината за ларвите на морските риби.
Однесување на корални риби
Студијата во 2020 година го оспорува потенцијалното негативно влијание на нивото на закиселување на океаните на крајот на векот врз однесувањето на коралните риби и сугерира дека ефектот може да биде занемарлив.[126] Лабораториските експерименти во контролирана средина покажале раст на видовите фитопланктони предизвикани од јаглерод диоксид.[127] Теренската студија на коралниот гребен во Квинсленд и Западна Австралија од 2007 до 2012 година тврди дека коралите се поотпорни на промените на pH на животната средина отколку што се сметло, поради внатрешната регулација на хомеостазата; ова ги прави топлинските промени, наместо закиселувањето, главниот фактор за ранливоста на коралните гребени поради климатските промени.[128]
Влијанијата на екосистемот

Додека целосните импликации на покачениот јаглерод диоксид врз морските екосистеми сè уште се документираат, постои значителен број на истражувања кои покажуваат дека комбинацијата на закиселување на океаните и покачена температура на океаните, предизвикани главно од јаглерод диоксид и други емисии на стакленички гасови, имаат сложен ефект за морскиот живот и океанската средина. Овој ефект далеку го надминува поединечното штетно влијание на било кој од нив.[131][132][133] Дополнително, затоплувањето на океаните ја влошува деоксигенацијата на океаните, што е дополнителен стрес за морските организми, со зголемување на стратификацијата на океаните, преку ефектите на густината и растворливоста, со што се ограничуваат хранливите материи,[134][135] додека во исто време се зголемува метаболичката побарувачка.
Анализите ја квантифицирале насоката и големината на штетните ефекти од закиселувањето на океаните, затоплувањето и деоксигенацијата на океанот.[136][137][138] Овие мета-анализи се дополнително тестирани од мезокосмочните студии [139][140] кои откриле катастрофален ефект врз мрежата на морската храна.
Небиолошки влијанија
Доколку се тргнат настрана директните биолошки ефекти, се очекува дека закиселувањето на океаните во иднина ќе доведе до значително намалување на закопувањето на карбонатните седименти за неколку векови, па дури и до растворање на постоечките карбонатни седименти.[141] Ова ќе предизвика зголемување на алкалноста на океаните, што ќе доведе до подобрување на океанот како резервоар за CO2 со импликации за климатските промени бидејќи повеќе CO2 ја напушта атмосферата за океанот.[142]
Влијанија врз човечката индустрија
Заканата од закиселување вклучува пад на комерцијалниот риболов и на арктичката туристичка индустрија и економија. Комерцијалниот риболов е загрозен бидејќи закиселувањето им штети на калцифицирачките организми кои ја сочинуваат основата на арктичките прехранбени мрежи.
Птероподите и кршливите ѕвезди ја сочинуваат основата на арктичките прехранбени мрежи и и двете се сериозно оштетени од киселоста. Школките на птероподите се раствораат со зголемена киселост и кршливите ѕвезди губат мускулна маса кога повторно растат додатоци.[143] За птероподите да создадат школки, потребен им е арагонит кој се произведува преку карбонатните јони и растворениот калциум. Птероподите се сериозно погодени бидејќи зголемените нивоа на закиселување постојано ја намалуваат количината на вода презаситена со карбонат што е потребна за создавање арагонит.[144] Водите на Арктикот се менуваат толку брзо што ќе станат незаситени со арагонит веќе во 2016 година [144] Дополнително, јајцата на кршливите ѕвезди умираат во рок од неколку дена кога се изложени на очекуваните услови кои произлегуваат од закиселувањето на Арктикот.[145] Закиселувањето се заканува да ги уништи арктичките прехранбени мрежи од основата нагоре. Арктичките прехранбени мрежи се сметаат за едноставни, што значи дека има неколку чекори во синџирот на исхрана од мали организми до поголеми грабливци. На пример, птероподите се „клучен плен на голем број повисоки грабливци - поголеми планктони, риби, морски птици, китови“.[146] И птероподите и морските ѕвезди служат како значителен извор на храна и нивното отстранување од едноставната прехранбена мрежа би претставувало сериозна закана за целиот екосистем. Ефектите врз калцифицирачките организми во основата на прехранбените мрежи може потенцијално да го уништат риболовот. Вредноста на рибата уловена од американскиот комерцијален риболов во 2007 година била проценета на 3,8 милијарди долари и од тие 73% се добиени од калцификатори и нивните директни грабливци.[147] Другите организми се директно оштетени како резултат на закиселување. На пример, намалувањето на растот на морските калцификатори како што се американскиот јастог, океанскиот квахог значи дека има помалку месо од школки достапно за продажба и потрошувачка.[148] Риболовот на црвениот рак е исто така во сериозна закана бидејќи раковите се калцификатори и се потпираат на карбонатните јони за развој на школка. Бебешкиот црвен кралски рак е изложен на зголемени нивоа на киселост и доживеал 100% смртност по 95 денови. Во 2006 година, црвениот крал сочинувал 23% од вкупната жетва, а сериозното намалување на популацијата на црвените ракови ќе ја загрози индустријата за берба на ракови.[149] Неколку океански стоки и услуги веројатно ќе бидат поткопани од идната киселост на океаните што потенцијално ќе влијае на егзистенцијата на околу 400 до 800 милиони луѓе во зависност од сценариото за емисија.[39]
Влијанија врз домородните народи
Закиселувањето може да ја оштети туристичката економија на Арктикот и да влијае на начинот на живот на домородните народи. Главниот столб на арктичкиот туризам е спортскиот риболов и ловната индустрија. Индустријата за спортски риболов е загрозена од уривање на прехранбените мрежи кои обезбедуваат храна за ценетите риби. Падот на туризмот го намалува влезот на приходите во областа и ги загрозува економиите кои се повеќе зависни од туризмот.[150] Брзото намалување или исчезнување на морскиот свет може да влијае и на исхраната на домородните народи.
Можни одговори

Намалување на емисиите на стакленички гасови
Членовите на Интеракадемскиот панел препорачале до 2050 година, глобалните антропогени емисии на јаглерод диоксид да се намалат за помалку од 50% од нивото од 1990 година.[16] Изјавата од 2009 година [16] исто така ги повикала светските лидери да:
- Признајте дека закиселувањето на океаните е директна и реална последица на зголемувањето на атмосферските концентрации на јаглерод диоксид, веќе има ефект при сегашните концентрации и веројатно ќе предизвика сериозна штета на важните морски екосистеми бидејќи концентрациите на јаглерод диоксид достигнуваат 450 [делови на милион (ppm)] и погоре;
- ... Признајте дека намалувањето на акумулацијата на јаглерод диоксид во атмосферата е единственото практично решение за ублажување на закиселувањето на океаните;
- ... Засилете ги активностите за намалување на стресните фактори, како што се прекумерниот риболов и загадувањето, на морските екосистеми за да се зголеми отпорноста на киселоста на океаните.[151]
Стабилизирањето на концентрациите на јаглерод диоксид во атмосферата на 450 ppm ќе бара краткорочни намалувања на емисиите, со поостри намалувања со текот на времето. Предлошка:Sfnp Германскиот советодавен совет за глобални промени [152] изјавил:
Со цел да се спречи нарушување на калцификацијата на морските организми и резултирачкиот ризик од фундаментално менување на морските прехранбени мрежи, треба да се почитува следнава заштитна шина: pH вредноста на блиските површински води не треба да падне повеќе од 0,2 единици под просечната вредност пред индустријата. во кој било поголем океански регион (ниту во глобалната средина).
Една цел на политиката поврзана со киселоста на океаните е големината на идното глобално затоплување. Страните на Рамковната конвенција на Обединетите нации за климатски промени (UNFCCC) усвоиле цел за ограничување на затоплувањето на под 2 °C, во однос на прединдустриското ниво.[153] Исполнувањето на оваа цел ќе бара значителни намалувања на антропогените емисии на јаглерод диоксид. Предлошка:Sfnp
Ограничување на глобалното затоплување на под 2 °C би значело намалување на pH на површината на океаните од 0,16 од прединдустриските нивоа. Ова би претставувало значителен пад на pH на површината на океаните. Предлошка:Sfnp
На 25 септември 2015 година, USEPA негирала [154] граѓанска петиција од 30 јуни 2015 година [155] со која се барало од ЕПА да го регулира јаглерод диоксидот под закон со цел да се ублажи закиселувањето на океаните. Во негирањето, ЕПА изјавила дека ризиците од закиселување на океаните се „поефикасно и поефективно третирани“ во рамките на домашните активности, на пример, во рамките на Претседателскиот акционен план за климата,[156] и дека се следат повеќе начини за работа со и во други нации да се намалат емисиите и уништувањето на шумите и да се промовира чиста енергија и енергетска ефикасност.
На 28 март 2017 година, САД со извршна наредба го укинале Акциониот план за климата.[157] На 1 јуни 2017 година било објавено дека САД ќе се повлечат од Париските договори [158] и на 12 јуни 2017 година дека САД ќе се воздржат од ветувањето за климатските промени на Г7,[159] два големи меѓународни напори за намалување на емисиите на јаглерод диоксид.
Други решенија како што се зголемување на земјиштето посветено на шумите и поттикнување на растот на морските растенија кои дишат CO2 може да го ублажат закиселувањето на океаните.[160]
Геоинженеринг
Геоинженерингот е предложен како можен одговор на закиселувањето на океаните. Изјавата на IAP (2009) [16] вели дека се потребни повеќе истражувања за да се докаже дека ова би било безбедно, достапно и вредно:
Пристапите за ублажување, како што е додавањето хемикалии за да се спротивстават на ефектите од закиселувањето, веројатно ќе бидат скапи, само делумно ефективни и само на локално ниво и може да претставуваат дополнителни неочекувани ризици за морската средина. Имаше многу малку истражувања за изводливоста и влијанијата на овие пристапи. Потребно е суштинско истражување пред да се применат овие техники.
Извештаите на WGBU (2006),[152] Кралското друштво на Обединетото Кралство (2009), Предлошка:Sfnp и Националниот совет за истражување на САД (2011) Предлошка:Sfnp предупредиле на потенцијалните ризици и тешкотии поврзани со климатското инженерство.
Железно оплодување
Железното оплодување на океанот може да ја стимулира фотосинтезата во фитопланктонот. Фитопланктонот би го претворил растворениот јаглерод диоксид во океанот во јаглехидрати и кислороден гас, од кои некои би потонале во подлабокиот океан пред да оксидираат. Повеќе од десетина експерименти на отворено море потврдиле дека додавањето на железо во океанот ја зголемува фотосинтезата во фитопланктонот до 30 пати.[161] Додека овој пристап е предложен како потенцијално решение за проблемот со киселоста на океаните, ублажувањето на закиселувањето на површинските океани може да ја зголеми закиселувањето во помалку населениот длабок океан.[162]
Извештајот на Кралското друштво на Обединетото Кралство (2009) Предлошка:Sfnp го прегледал пристапот за делотворност, достапност, навременост и безбедност. Оценката за достапност била „средна“ или „не се очекува да биде многу исплатлива“. За останатите три критериуми, оценките се движеле од „ниска“ до „многу ниска“ (т.е. не е добра). На пример, во однос на безбедноста, извештајот открил „[висок] потенцијал за несакани еколошки несакани ефекти“ и дека оплодувањето на океаните „може да ги зголеми аноксичните региони на океаните („ мртвите зони“)“. Предлошка:Sfnp
Глобални цели

Проблемот со закиселувањето на океаните е вклучен во една од целите на Обединетите нации: Цел 14 за одржлив развој на:[17] Закиселувањето на океаните директно се решава со целта SDG 14.3. Целосниот наслов на Целта 14.3 е: „Минимизирање и решавање на влијанијата од закиселувањето на океаните, вклучително и преку засилена научна соработка на сите нивоа“.[164] Оваа цел има еден индикатор: Индикатор 14.3.1 е „Просечна киселост на морето (pH) измерена на договорениот пакет на претставителни станици за земање примероци“.[165]
Закиселување во геолошкото минато
Закиселувањето на океаните се случило претходно во историјата на Земјата,[18] и резултирачкиот еколошки колапс во океаните имал долготрајни ефекти врз глобалниот циклус на јаглерод и климата.[19][20] Најзабележителен пример е палеоценско-еоценскиот топлински максимум (PETM),[166] кој се случил приближно пред 56 милиони години кога огромни количества јаглерод навлегле во океанот и атмосферата и довело до растворање на карбонатните седименти во сите океански басени.
Три од големите пет настани на масовно истребување во геолошкото минато биле поврзани со брзо зголемување на јаглерод диоксидот во атмосферата, веројатно поради вулканизам и/или топлинска дисоцијација на хидратите на морскиот гас.[167][168] Раните истражувања фокусирани на климатските ефекти на покачените нивоа на јаглерод диоксид врз биолошката разновидност,[169] но во 2004 година, намалената заситеност на CaCO3 поради навлегувањето во морска вода на вулканогениот јаглерод диоксид било предложено како можен механизам за убивање за време на морското масовно изумирање на крајот на Тријас.[170] Крајната тријаска биотска криза сè уште е најдобро воспоставениот пример за морско масовно изумирање поради закиселување на океаните, бидејќи (а) вулканската активност, промените во јаглеродните изотопи, намалувањето на карбонатната седиментација и морското изумирање се совпаднале токму во стратиграфскиот запис,[171][172][173][174] и (б) имало изразена селективност на истребувањето против организми со дебели арагонитни скелети,[171][175][176] што е предвидено од експериментални студии.[90][91][177][178] Закиселувањето на океаните, исто така, е предложено како причина за крајно-пермското масовно изумирање [179][180] и крајната криза во периодот Креда.[181]
Галерија
-
„Денешен ден“ (1990-ти) pH на морската површина
-
Денешна алкалност
-
„Денешен ден“ (1990-ти) антропоген Предлошка:Хем на морската површина
-
Вертикален инвентар на „денешно време“ (1990-ти) антропогени Предлошка:Хем
-
Промена на површинскиот Предлошка:Хем јони од 1700-тите до 1990-тите
-
Денешниот DIC
-
Прединдустриски DIC
-
NOAA (AOML) in situ Предлошка:Хем сензор за концентрација (SAMI-CO2), прикачен на станица на системот за рано предупредување на коралниот гребен, користен при спроведување на проучувања за закиселување на океаните во близина на областите на коралните гребени
Наводи
Надворешни врски
- Глобална мрежа за набљудување на киселоста на океаните (GOA-ON)
- Декада на океанските науки за одржлив развој на Обединетите нации (2021-2030)
- ↑ 1,0 1,1 1,2 Предлошка:Наведено списание
- ↑ 2,0 2,1 Предлошка:Наведено списание
- ↑ 3,0 3,1 Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ 7,0 7,1 Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведено списание
- ↑ 13,0 13,1 13,2 13,3 13,4 Предлошка:Наведено списание
- ↑ Предлошка:Наведени вести
- ↑ Предлошка:Наведено списание
- ↑ 16,0 16,1 16,2 16,3 Предлошка:Наведена мрежна страница, Secretariat: TWAS (the Academy of Sciences for the Developing World), Trieste, Italy.
- ↑ 17,0 17,1 Предлошка:Наведена мрежна страница
- ↑ 18,0 18,1 Предлошка:Наведено списание
- ↑ 19,0 19,1 Предлошка:Наведено списание
- ↑ 20,0 20,1 Предлошка:Наведени вести
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ 23,0 23,1 Предлошка:Наведено списание
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена книга
- ↑ 26,0 26,1 Предлошка:Наведена мрежна страница
- ↑ 27,0 27,1 Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ 29,0 29,1 Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведена книга
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведена мрежна страница
- ↑ 39,0 39,1 39,2 Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ 42,0 42,1 Предлошка:Наведено списание Предлошка:Отворен пристап
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ 45,0 45,1 Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведени вести
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ United States National Research Council, 2010. Ocean Acidification: A National Strategy to Meet the Challenges of a Changing Ocean Предлошка:Семарх
- ↑ Предлошка:Наведени вести JournalistsResource.org, retrieved 14 March 2012
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведени вести
- ↑ 65,0 65,1 Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведување
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведено списаниеПредлошка:Мртва врска
- ↑ 79,0 79,1 79,2 79,3 79,4 Raven, JA, et al. (2005) "Ocean acidification due to increasing atmospheric carbon dioxide". Royal Society, London, UK.
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Cite book
- ↑ The Royal Society. Ocean Acidification Due To Increasing Atmospheric Carbon Dioxide, The Clyvedon Press Ltd. (2005): 11.
- ↑ Предлошка:Наведено списание
- ↑ 84,0 84,1 Предлошка:Наведено списание
- ↑ 85,0 85,1 Предлошка:Наведено списание
- ↑ Предлошка:Наведени вести
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведено списание
- ↑ 90,0 90,1 Предлошка:Наведено списание
- ↑ 91,0 91,1 Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведени вести
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ 104,0 104,1 Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведено списание
- ↑ Acid In The Oceans: A Growing Threat To Sea Life by Richard Harris. All Things Considered, 12 August 2009.
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведени вести
- ↑ Предлошка:Наведена мрежна страница
- ↑ 123,0 123,1 Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ 125,0 125,1 125,2 Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Chan, F., Barth, J.A., Kroeker, K.J., Lubchenco, J. and Menge, B.A. (2019) "The dynamics and impact of ocean acidification and hypoxia". Oceanography, 32(3): 62–71. Предлошка:Doi.
 Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
- ↑ Gewin, V. (2010) "Oceanography: Dead in the water". Nature, 466(7308): 812. Предлошка:Doi.
- ↑ Kroeker, et al. (June 2013) "Impacts of ocean acidification on marine organisms: quantifying sensitivities and interaction with warming." Glob Chang Biol. 19(6): 1884–1896
- ↑ Harvey, et al. (April 2013) "Meta-analysis reveals complex marine biological responses to the interactive effects of ocean acidification and warming." Ecol Evol. 3(4): 1016–1030
- ↑ Nagelkerken Global alteration of ocean ecosystem functioning due to increasing human CO2 emissions, PNAS vol. 112 no. 43, 2015
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Harvey wt al Ecol Evol. 2013 Apr; 3(4): 1016–1030
- ↑ Gruber, Nicolas. "Warming up, turning sour, losing breath: ocean biogeochemistry under global change." Philosophical Transactions of the Royal Society of London A: Mathematical, Physical and Engineering Sciences 369.1943 (2011): 1980–1996.
- ↑ Anthony, et al. (May 2011) "Ocean acidification and warming will lower coral reef resilience." Global Change biology, Volume 17, Issue 5, Pages 1798–1808
- ↑ Goldenberg, Silvan U, et al. (2017) "Boosted food web productivity through ocean acidification collapses under warming." Global Change Biology.
- ↑ Pistevos, Jennifer CA, et al. (2015) "Ocean acidification and global warming impair shark hunting behaviour and growth." Scientific reports 5: 16293.
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведена мрежна страница
- ↑ 144,0 144,1 Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведени вести
- ↑ 152,0 152,1 Предлошка:Harvp
- ↑ Предлошка:Наведено списание Document available in UN languages and text format.
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведена книга
- ↑ Предлошка:Наведено списание
- ↑ Ritchie, Roser, Mispy, Ortiz-Ospina. "SDG 14 - Measuring progress towards the Sustainable Development Goals." SDG-Tracker.org, website (2018).
- ↑ United Nations (2017) Resolution adopted by the General Assembly on 6 July 2017, Work of the Statistical Commission pertaining to the 2030 Agenda for Sustainable Development (A/RES/71/313)
- ↑ Предлошка:Наведена мрежна страница
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведување
- ↑ Предлошка:Наведена книга
- ↑ Предлошка:Наведено списание
- ↑ 171,0 171,1 Предлошка:Наведено списаниеПредлошка:Мртва врска
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведување
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание
- ↑ Предлошка:Наведено списание








